答弁本文情報
平成十五年六月六日受領答弁第五五号
内閣衆質一五六第五五号
平成十五年六月六日
衆議院議長 綿貫民輔 殿
衆議院議員長妻昭君提出医薬品の副作用に関する質問に対し、別紙答弁書を送付する。
衆議院議員長妻昭君提出医薬品の副作用に関する質問に対する答弁書
一について
一般に、医薬品の副作用とは、疾病の治療等のために用いられる医薬品の使用により人に発現する有害で意図しない反応をいうものと承知している。
なお、お尋ねの「副作用情報(二万六五七五件)」とは、薬事法(昭和三十五年法律第百四十五号)第七十七条の四の二の規定に基づき、医薬品の製造業者等から厚生労働大臣に対してなされる、医薬品の副作用によるものと疑われる疾病等又は医薬品の使用によるものと疑われる感染症の発生の報告及び「医薬品等安全性情報報告制度へのご協力について(お願い)」(平成九年五月十五日付け薬発第六百三十三号厚生省薬務局長通知)に基づき、医療機関又は薬局から厚生労働省に対してなされる、医薬品の使用の結果見られた副作用又は感染症の報告(以下「副作用等報告」という。)のうち、平成十三年四月一日から平成十四年三月三十一日までの期間に報告された二万六千五百七十五症例の報告のことと推察されるが、医療機関又は薬局から厚生労働省に対してなされた報告のうち三十症例は医薬品以外に関するものであるため、同期間における医薬品に関する副作用等報告(以下「平成十三年度副作用等報告」という。)は、二万六千五百四十五症例である。
副作用等報告は、製造業者等又は医療機関若しくは薬局が、広く医薬品の副作用によるものと疑われる疾病等を知ったときは、厚生労働省に報告するよう求めているものであり、副作用等報告があった各症例等について、副作用によるものであるか否かの認定は行っていない。
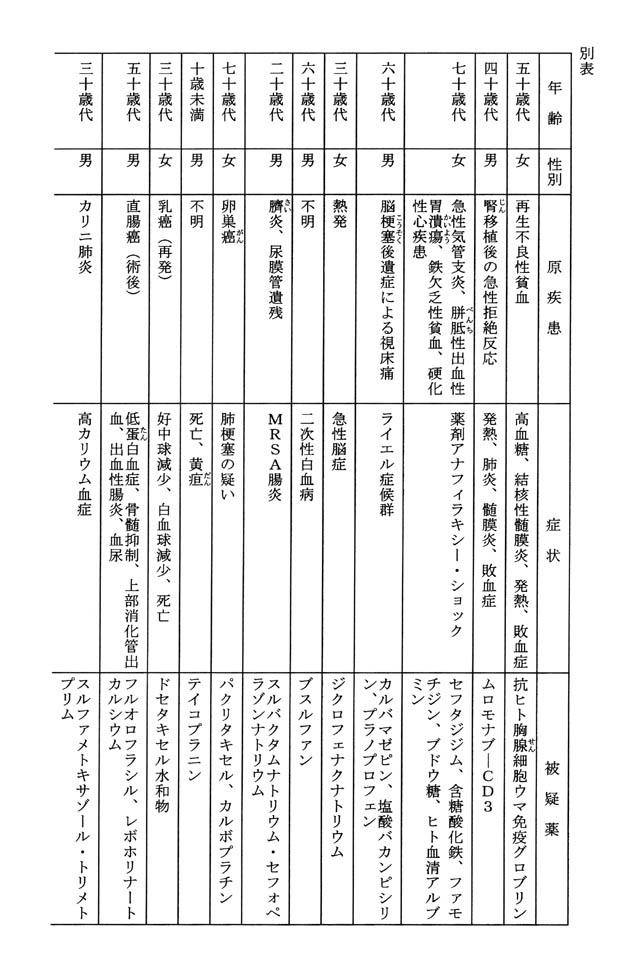
平成十三年度副作用等報告のうち、医薬品の副作用によるものと疑われる疾病等又は医薬品の使用によるものと疑われる感染症の発生との因果関係の有無を問わず、患者が死亡したと報告を受けた症例(以下「死亡症例」という。)は、千九百三十三症例である(ただし、同一の症例が複数の者から報告されること等があり得る。)。死亡症例のうち、報告時期が早い順に五十症例の報告内容を示せば、別表のとおりである。
副作用等報告については、医薬品副作用被害救済・研究振興調査機構が管理を行っている「医薬品情報提供システム」において公表している。「医薬品情報提供システム」は、医師、歯科医師及び薬剤師を対象に、医療用医薬品の安全な使用に役立てることを目的として、医療用医薬品の副作用が疑われる症例報告に関する情報等を広く提供するものとして平成十一年四月二十八日に開始された事業であり、医療用医薬品の使用によるものと疑われる感染症に係る症例及び一般用医薬品に係る症例は、その対象となっていない。
平成十三年度副作用等報告については、死亡症例千九百二十六症例を含む二万六千百八十八症例を公表している。死亡症例のうち七症例については、医療用医薬品の使用によるものと疑われる感染症に係る症例及び一般用医薬品に係る症例であるため、公表していない。
なお、「医薬品情報提供システム」における公表に当たっては、副作用が疑われるとして報告された症例のうち、いまだ十分な情報がなく、当該副作用が医薬品の添付文書又は容器若しくは被包の使用上の注意に記載されるに至っていないため、同様の症例の収集を必要とするものについては、その症例に関する性別、年齢、原疾患、被疑薬、副作用、転帰等の情報を公表し、使用上の注意から予測できる副作用に係るものについては、使用上の注意の改訂の際参考とした症例の経過が分かる情報等を公表することとしている。
薬事法第七十七条の四の二の規定に基づき製造業者等に厚生労働大臣への報告が義務付けられている症例について、製造業者等が厚生労働大臣に報告しないものを把握することは困難であるため、お尋ねのような情報がどの程度あるかは不明である。
平成五年度から平成十四年度までの十年間において、医薬品の製造業者等が定められた期間内に副作用等報告を行わなかったことを理由とする行政処分は、行っていない。
なお、副作用等報告に関するものではないが、平成十二年度に、体外診断用医薬品についての外国における措置の実施に関する報告の遅延があった製薬企業一社に対し、行政処分を行っている。これは、当該製薬企業に対して、過去に同様の報告の遅延に対して行政指導を行ったにもかかわらず、違反行為が繰り返されたため、十日間の業務停止処分を行ったものである。
薬事法に違反した製造業者等に対しては、薬事法第七十五条第一項の規定に基づく業務停止等の行政処分又は行政指導を行うこととしている。具体的には、故意又は重過失によるものか否か、健康被害が発生し、又は発生するおそれが高かったか否か、繰り返し行われたものであるのか否か等の違反行為の態様を勘案した上で、行政としての対応を決定しているところであり、平成五年度から平成十四年度までの十年間においては、こうした判断基準に照らし、定められた期間内に医薬品の副作用等報告を行わなかったことを理由として行政処分が必要と判断される事例はなかったものと考えている。
副作用等報告において、患者が死亡した症例は、「医薬品の副作用によるものと疑われる死亡」として報告されるものであり、「医薬品の副作用で死亡した」として報告されるものではない。なお、「医薬品の副作用によるものと疑われる死亡」に当たるかどうかについては、当該症例にかかわった医師等の医薬関係者及びそれを知った製造業者等が、その医学、薬学等に関する専門的知識に基づき、患者の年齢、性別、原疾患、合併症、既往歴、経過等を総合的に評価した結果、医薬品の副作用との因果関係が否定できないと判断したものと承知している。
医薬品の副作用で死亡する患者数については、把握していない。なお、平成十三年度副作用等報告のうち、「医薬品の副作用によるものと疑われる死亡」として報告されている症例の数は、千二百三十九症例である(ただし、同一の症例が複数の者から報告されること等があり得る。)。
従来から、製造業者等による情報収集、厚生労働大臣への報告等を通じて、医薬品に係る副作用及び感染症に関する情報収集を行うとともに、これに基づき対策の検討を行い、医薬品の適正な使用の確保のために必要な措置が講じられるよう努めてきたところである。また、平成十三年十月から、新医薬品の販売開始後の六か月間は、製造業者等が医療機関に対して確実な情報提供、注意喚起等を行い、当該新医薬品の適正使用を促すとともに、重篤な副作用又は感染症が発生した場合には、その情報を迅速に収集し、必要な安全対策を実施し、副作用等の被害を最小限にすることを主な目的とする市販直後調査が義務付けられたところである。
さらに、薬事法及び採血及び供血あつせん業取締法の一部を改正する法律(平成十四年法律第九十六号)により、市販後安全対策の一層の充実を図るため、平成十五年七月三十日からは、医師等の医薬関係者等に対して、医薬品に係る副作用及び感染症に関し、直接厚生労働大臣に報告することが義務付けられ、副作用及び感染症に関する情報収集の強化が図られることとなっている。また、平成十六年四月に設立を予定している独立行政法人医薬品医療機器総合機構においても、医薬品の安全性に関する情報収集及び市販後の副作用等に関する情報の科学的かつ客観的な評価を行うこととしており、医薬品の安全性に関する情報収集体制の拡充強化が図られる予定である。
今後とも、これらの施策を通じて、医薬品の副作用等に対して適切な安全対策を講ずるよう努めてまいりたい。