答弁本文情報
平成八年三月八日受領答弁第一号
内閣衆質一三六第一号
平成八年三月八日
衆議院議長 土井たか子 殿
衆議院議員山本孝史君提出血液製剤によるHIV(エイズウイルス)感染に関する質問に対し、別紙答弁書を送付する。
衆議院議員山本孝史君提出血液製剤によるHIV(エイズウイルス)感染に関する質問に対する答弁書
一の1について
厚生省において御指摘の報告文書が提出された当時の薬務局生物製剤課の職員に対して事情聴取を行ったところ、御指摘の件については、同課の職員による検討が行われたが、御指摘の報告文書がエイズの原因等エイズに関する新たな知見を提供するものではなかったことから、上司に相談し、又は報告することはなかったものである。
御指摘の報告においては、米国トラベノール社が米国において回収した製品と同一の原料血漿を用いた製品に関し、我が国に輸入されたものについては出荷停止措置が採られたこと及びその他のものについては我が国に輸入されていないこと並びにそれぞれの製品のロット番号等が記載されていたところである。
御指摘の「自動的リコール」問題については、米国食品医薬品局(FDA)が千九百八十三年(昭和五十八年)に血液製剤諮問委員会(BPAC)の勧告に基づき、後にエイズと判明した供血者の血漿を含むロットから製造された血液凝固因子製剤に対するリコール決定は「ケースバイケースの原則」を採用していたと承知しているが、厚生省としては、これまでこのことをもって当時の同省の対応に誤りがなかったと主張したことはない。
なお、千九百九十五年(平成七年)の米国医学会の報告「エイズウイルスと血液供給」においては、千九百八十三年当時、米国食品医薬品局が汚染された製品と同じロットの製品すべてを自動的に回収する「自動的リコール」を行わず、「ケースバイケースの原則」を採用した理由は、「自動的リコール」を行うことにより、血友病患者の生命維持に不可欠な血液凝固因子製剤の不足をもたらすことを回避する必要があったためとの旨が記載されている。
昭和五十八年当時において必要な原料血漿をすべて国内で確保することは、供血者の確保等の問題があり、困難であった。
厚生省において昭和五十八年当時の薬務局生物製剤課の職員に対して事情聴取を行ったところ、当時同課としては、加熱血液凝固因子製剤については、血液凝固因子の活性の変化、加熱により変性した蛋白質を抗原とする急性のショック症状、血液凝固因子製剤を無効にするインヒビターの発生等の新たな副作用等明らかにされなければならない問題点があり、医薬品としての有効性及び安全性を判断するためには、我が国においても臨床試験が必要であると考えており、緊急輸入を行うこととはしなかった。
また、国内で確保される原料血漿から製造される濃縮血液凝固因子製剤への転換については、推進を図ることとされていたものの、当時その供給量に限界があったため、直ちに実施することは困難であった。
さらに、クリオプレシピテート製剤への転換については、濃縮製剤に比してアレルギー反応等の副作用が比較的多いことや血友病患者の社会生活を制限すること等を考慮したため実施しなかった。
厚生省において昭和五十八年当時の薬務局生物製剤課の職員に対して事情聴取を行ったが、御指摘の件について記憶している者はいなかった。また、当時の中央薬事審議会血液製剤特別部会及び血液製剤調査会の議事要旨の調査をしたが、御指摘の件について記載はない。
御指摘の件について御指摘の小委員会においていつ検討がなされたか記録は残されていないが、昭和五十九年三月二十九日に提出された同小委員会の報告書においては、アレルギー反応が比較的多いこと等の問題点が指摘されており、結論として「クリオの適応拡大には限界があり、補充療法の主体が濃縮製剤にしようあることに変りはない。より安全な因子補充療法のためには、汚染の少ない血漿の確保や加熱処理のような製法の改良などによってこの問題が対処されるべきである。」と記載されている。
当時の厚生省薬務局生物製剤課における検討の結果、御指摘の通達は出さなかった。
また、厚生省において当時の薬務局長及び同局生物製剤課長に対して事情聴取を行ったが、御指摘の件について報告がなされたか否かについては確認できなかった。
厚生省において当時の薬務局生物製剤課の職員に対して事情聴取を行ったところ、御指摘の件については、非加熱血液凝固因子製剤は製薬企業において自主的に回収されていると承知していたところであり、御指摘のような当該製剤の新たな出荷を容認する趣旨ではなく、また、そのような意向を各製薬企業に伝えた事実はない。
厚生省において当時の薬務局生物製剤課の職員に対して事情聴取を行ったところ、昭和六十年秋ごろから昭和六十一年初めにかけて各製薬企業から個別に非加熱血液凝固因子製剤の回収状況について説明を受けていたが、その方法及び内容について具体的に記憶している者はいなかった。
従来厚生省としては、株式会社ミドリ十字からの非加熱血液凝固第皿因子製剤の最終の出荷については昭和六十一年二月と承知していたが、平成八年二月に同省において再度同社に報告を求めたところ、同社からこれまでと異なる回答があった。このため、同月、同省において薬事法(昭和三十五年法律第百四十五号)第六十九条第一項の規定に基づく立入検査を実施したところ、昭和六十一年十二月まで当該製剤が出荷されていたことが判明した。
御指摘の件について、厚生省において平成八年二月に財団法人化学及血清療法研究所、日本臓器製薬株式会社、バイエル薬品株式会社、バクスター株式会社及び株式会社ミドリ十字に対して再度報告を求めたところ、株式会社ミドリ十字から、これまでと異なる回答があった。このため、同月、同省において同社に対し薬事法第六十九条第一項の規定に基づく立入検査を実施したところ、同社においては昭和六十三年七月まで非加熱血液凝固第皿因子製剤を卸売業者から回収していたことが判明した。同社以外の各社については、御指摘の報告において回収終了年月日として報告されている時期までに卸売業者の在庫についてはおおむね回収を終了していたとの回答があったが、現在その確認を行っているところである。
薬事法第四十二条第一項の規定に基づき生物学的製剤基準を定めた医薬品の薬価基準への収載については、基本的に生物学的製剤基準に定あられた一般的名称によっているところであり、血液凝固第VIII因子製剤及び同第IX因子製剤については、生物学的製剤基準に基づき非加熱製剤と加熱製剤の区別及び製品ごとの区別を行わずに一般的名称で収載されていることから、非加熱製剤のみを区別して社会保険の適用から除外することは行っていない。
厚生省において平成八年二月に御指摘の二社に対して確認したところ、いずれの社についても原料血漿の輸出元から非加熱血液凝固因子製剤の原料血漿の供血者が供血後エイズ症状を呈したという報告又はエイズウイルスに感染していることが判明したという報告を受けたことはないとの回答があったところであり、御指摘のようなことはなかったと承知している。
厚生省は、御指摘の抗体検査の実施についての指示等は行っていない。
また、厚生省において平成八年二月に株式会社ミドリ十字に対して報告を求めたところ、御指摘の検査は実施していないとの回答があった。
なお、御指摘の検査によっては濃縮血液凝固因子製剤へのエイズウイルスの混入を検出することはできないものである。
六の1及び2について
御指摘の点について、厚生省において平成八年二月に株式会社ミドリ十字に対して報告を求めたところ、再生を行った理由については「当時の状況と致しまして、本剤の特質である血友病患者への継続的安定供給が必須であること、また、非加熱製剤から加熱製剤への切り替えが急を要す一方で、第皿因子製剤の原料確保には種々の制約があり、早急に加熱製剤で必要量を充足するには、回収した非加熱製剤を再生する他はありませんでした。」と及び再生の手順については、回収された製剤を溶解し、除菌ろ過を行った後、凍結乾燥を経て、加熱処理を行い、その後製造承認書の規格に合格したものを国家検定を受けた上で供給したとの回答があった。
また、厚生省において平成八年二月に薬事法第六十九条第一項の規定に基づく立入検査を実施したところ、加熱製剤の原画分とするため、回収された非加熱製剤の溶解を行ったのは昭和六十年七月から昭和六十一年四月までであること及び当該原画分については、滅菌し、加熱処理を経て加熱製剤に加工されていたことが明らかとなった。
厚生省としては、昭和六十二年三月の社団法人日本血液製剤協会の報告に御指摘の事実が記載されていることは承知しているが、同省において当時の薬務局生物製剤課の職員に対して事情聴取を行ったところ、当該事実について同報告以前に報告を受けたと記憶している者はいなかった。
血液凝固第以因子製剤のうち、非加熱製剤についての薬事法第十四条第一項の規定に基づく製造承認における申請者名、販売名及び承認年月日については以下のとおりである。また、いずれの製品についても、申請に当たって効能又は効果として記載された適応症は血液凝固第皿因子欠乏症である。
日本製薬株式会社 PPSB ― ニチヤク 昭和四十七年四月二十二日
株式会社ミドリ十字 クリスマシン 昭和五十一年十二月二十七日
血液凝固第IX因子製剤のうち、非加熱製剤についての薬事法第二十三条において準用する同法第十四条第一項の規定に基づく輸入販売承認における申請者名、販売名及び承認年月日については以下のとおりである。また、いずれの製品についても、申請に当たって効能又は効果として記載された適応症は血液凝固第IX因子欠乏症である。
株式会社ミドリ十字 コーナイン 昭和四十七年四月二十二日
株式会社カッター・ラボラトリース・パシフィック コーナイン 昭和五十三年一月二十七日
住友化学工業株式会社 プロプレックス 昭和五十五年五月十五日
日本臓器製薬株式会社 ベノビール 昭和五十七年一月二十八日
日本トラベノール株式会社 プロプレックス 昭和五十八年五月二十三日
血液凝固第IX因子製剤のうち、加熱製剤についての薬事法第十四条第一項に基づく製造承認における申請者名、販売名及び承認年月日については以下のとおりである。また、いずれの製品についても、申請に当たって効能又は効果として記載された適応症は血液凝固第IX因子欠乏症である。
株式会社ミドリ十字 クリスマシン ― HT 昭和六十年十二月十七日
日本製薬株式会社PPSB ― HT「ニチヤク」 昭和六十一年十一月十九日
血液凝固第IX因子製剤のうち、加熱製剤についての薬事法第二十三条において準用する同法第十四条第一項の規定に基づく輸入販売承認における申請者名、販売名及び承認年月日については以下のとおりである。また、いずれの製品についても、申請に当たって効能又は効果として記載された適応症は血液凝固第IX因子欠乏症である。
カッター・ジャパン株式会社 コーナインHT 昭和六十年十二月九日
財団法人化学及血清療法研究所 ノバクトF 昭和六十一年二月十日
トラベノール株式会社 プロプレックスST 昭和六十一年四月二十三日
日本臓器製薬株式会社 ベノビールTIM4 昭和六十一年四月二十三日
日本製薬株式会社のPPSB ― ニチヤクについては、昭和五十年五月二日に効能又は効果として「凝固因子(第II、VII、X)欠乏に基づく出血」が追加されている。
御指摘の内容については、安田純一氏の医学的専門知識に基づいて記述されたものと考えている。
御指摘の内容については、当該記述の執筆者が医学的専門知識に基づいて血液凝固第IX因子製剤の成分から使用可能と考えられる症例を記述したものと考えている。
厚生省において平成八年二月に白幡聡産業医科大学教授に確認したところ、平成五年度HIV感染者発症予防・治療に関する研究班報告書の記述のとおり、ビタミンK欠乏症患者のエイズウイルス感染判定は平成五年十月十三日である。
厚生省において平成八年二月に御指摘の件について報告を行った岡敏明旭川医科大学非常勤講師に確認したところ、平成六年度HIV感染者発症予防・治療に関する研究班報告書の記述のとおり、プロテインC欠損症患者のエイズウイルス感染の確認は昭和六十年である。
厚生省としては、御指摘のビタミンK欠乏症患者の事例については平成六年六月三十日の、プロテインC欠損症患者の事例については平成七年二月十七日のHIV感染者発症予防・治療に関する研究班(以下「予防・治療研究班」という。)の発表により承知したものであり、また、御指摘の「生物学的製剤基準(解説編)」等に記述された疾病について、具体的な投与例は承知していなかったことから平成七年十一月八日において御指摘の答弁を行ったところである。
厚生省としては、平成六年六月の予防・治療研究班における非血友病患者のエイズウイルス感染事例の報告以後、同研究班が実施した血液凝固因子製剤による非血友病HIV感染者調査の結果を公表し、当該調査の対象となった医療機関に対し、感染者に対するカウンセリング等の対応について依頼するとともに、都道府県等を通じて、全国の医療機関に対し、同様の製剤投与事例の自主点検等の協力を依頼している。さらに、都道府県等を通じて、製剤が投与された可能性のある医療機関を対象として血液凝固因子製剤による非血友病HIV感染者調査を行っているところである。
これらの調査については、カルテの保存期間が経過していること、担当医師が異動していること等の制約があるが、情報の収集に努めるよう医療機関の協力を求めているところである。
血液凝固因子製剤の投与によるエイズウイルス感染者については、後天性免疫不全症候群の予防に関する法律(平成元年法律第二号)第五条の規定に基づく医師の都道府県知事への報告義務はないため、従来から予防・治療研究班において班員の自主的な協力に基づいて把握した感染者数が御指摘の委員会に報告されているところである。同研究班から血液凝固因子製剤による血友病以外のエイズウイルス感染者が初めて報告されたのは、平成七年七月二十八日の同委員会においてである。
御指摘の委員会では、予防・治療研究班からの報告を受け、血液凝固因子製剤による患者及び感染者の累計数に当該事例数を加えて厚生省に報告した。
御指摘の委員会は、厚生省保健医療局長の私的諮問機関として、エイズ対策の専門家により、後天性免疫不全症候群の予防に関する法律に基づく感染者報告の内容を検討し、その発生状況を把握すること等の所掌事務を遂行しており、我が国のエイズ対策に重要な役割を果たしていると考えている。
厚生省において当時の薬務局生物製剤課の職員に対して事情聴取を行ったところ、血液凝固第IX因子製剤の血友病患者以外の患者に対する使用状況については承知していなかったため、御指摘の通知は行っていない。
エイズウイルスに感染した血友病患者については、先天性血液凝固因子障害治療研究事業によって医療保険制度による患者の自己負担部分について公費負担を行っているが、この事業は、血友病という疾患に着目し、患者の身体的及び心理的負担を軽減するために実施しているものであり、血友病以外のエイズウイルス感染者を対象とすることは困難である。
厚生省としては、平成七年九月から都道府県等を通じて非加熱製剤が投与された可能性のある医療機関に対し、血液凝固因子製剤による非血友病HIV感染者調査を実施しているところであるが、さらに、平成八年二月に薬事法第六十九条第一項の規定に基づき、当該製剤の製造業者及び輸入販売業者に対して、当該製剤を納入した医療機関について報告を求めることにより、この調査の徹底を図っているところである。
御指摘の「血液製剤」及び「生物学的製剤基準(解説編)」については、当時の厚生省薬務局生物製剤課及び現在の同局企画課血液事業対策室において必要に応じて利用しているものである。
御指摘の報告書は千九百九十四年(平成六年)十月二十五日付けのドイツ連邦議会の「第二決議勧告及び最終報告」(Zweite Beschlu※(注)empfehlung und Schlu※(注)bericht vom 25 October 1994 ― Drucksache ― 12/8591 ― )であると思われるが、その報告書については厚生省においては、平成七年二月に入手した。
御指摘の報告書には、御指摘の事項について複数の記述箇所があるが、例えば、二・七・一・一・一においては血液製剤によりエイズウイルスに感染した血友病患者の数に関してW・シュラム教授によれば「合計千三百五十八人の血友病患者がエイズウイルスに感染したが」と、二・七・一・一・三・二においては血液製剤によりエイズウイルスに感染した非血友病患者の数に関して「千九百九十三年(平成五年)十月に、連邦保健庁は把握しているPPSBによるエイズウイルス感染者は七十六人であると発表した。」と記述がある。
御指摘の報告書には、産婦に関するエイズウイルス感染の事例として二・四・二・六・三において「彼女の場合で考えられる唯一の感染経路は、千九百八十四年十一月に行われた帝王切開手術でべーリンガー・ヴェルケ社製のPPSBを投与されたことである。」と記述がある。
現在厚生省が実施している血液凝固因子製剤による非血友病HIV感染者調査においては、血液製剤製造企業から提出された非加熱濃縮血液凝固第IX因子製剤を投与した可能性のある医療機関のリストに基づき、都道府県等を通じて当該医療機関に調査依頼しているものであり、診療科を特定しているものではないので、御指摘のように産婦人科の医療施設を対象にしていないというものではない。
当時、厚生省においては、御指摘の報道については入手していなかった。医薬品に関する海外の情報の収集については、担当部署において文献等を講読する等の外、製薬企業等からも情報を提供されているところである。
個々の患者の症状によって血液製剤の使用量が異なることから、血友病A又は血友病Bの患者について治療のために必要な血液製剤の量を把握することは困難であり、御指摘のような最低限確保すべき量については厚生省として把握していない。
厚生省において平成八年二月に各血液製剤製造企業に対し、非加熱濃縮血液凝固第皿因子製剤及び非加熱濃縮血液凝固第皿因子製剤について御指摘の事項を照会したところ、その回答の内容は以下のとおりであった。
財団法人化学及血清療法研究所が昭和五十三年八月一日に薬事法第十四条第一項の規定に基づく製造承認を受けた非加熱濃縮血液凝固第VIII因子製剤コンファクト8について、昭和五十五年度から昭和六十年度までの販売量は別表第一のとおりである。また、昭和六十年九月以後は販売を行っていない。なお、月ごとの販売量については、記録が無いため不明である。
日本製薬株式会社が昭和五十三年八月一日に薬事法第十四条第一項の規定に基づく製造承認を受けた非加熱濃縮血液凝固第VIII因子製剤ハイクリオについて、昭和五十九年四月から昭和六十二年三月までの出荷量は別表第二のとおりである。なお、昭和五十九年三月以前の出荷量については、記録が無いため不明である。
日本製薬株式会社が昭和四十七年四月二十二日に薬事法第十四条第一項の規定に基づく製造承認を受けた非加熱濃縮血液凝固第IX因子製剤PPSB ― ニチヤクについて、昭和五十九年四月から昭和六十二年二月までの出荷量は別表第三のとおりである。また、昭和六十二年三月以後は出荷を行っていない。なお、昭和五十九年三月以前の出荷量については、記録が無いため不明である。
日本臓器製薬株式会社が昭和五十三年八月一日に薬事法第二十三条において準用する同法第十四条第一項の規定に基づく輸入販売承認を受けた非加熱濃縮血液凝固第VIII因子製剤クリオブリンについては、同社の出荷台帳等が既に廃棄されているため、承認から販売停止までの供給量(販売量)等については不明である。
日本臓器製薬株式会社が昭和五十七年一月二十八日に薬事法第二十三条において準用する同法第十四条第一項の規定に基づく輸入販売承認を受けた非加熱濃縮血液凝固第IX因子製剤ベノビールについては、同社の出荷台帳等が既に廃棄されているため、承認から販売停止までの供給量(販売量)等については不明
バイエル薬品株式会社(昭和五十四年十二月三十一日まではカッター・ラボラトリース・パシフィック株式会社、昭和五十五年一月一日から昭和六十三年十二月三十一日まではカッター・ジャパン株式会社。以下同じ。)が昭和五十三年八月一日に薬事法第二十三条において準用する同法第十四条第一項の規定に基づく輸入販売承認を受けた非加熱濃縮血液凝固第VIII因子製剤コーエイトについて、昭和五十四年から昭和六十年までの販売量は別表第四のとおりである。なお、月ごと及び昭和五十三年の販売量については、記録が無いため不明である。
バイエル薬品株式会社が昭和五十三年一月二十七日に薬事法第二十三条において準用する同法第十四条第一項の規定に基づく輸入販売承認を受けた非加熱濃縮血液凝固第IX因子製剤コーナインについて、昭和五十三年から昭和六十年の販売量は別表第五のとおりである。なお、月ごとの販売量については、記録が無いため不明である。
バクスター株式会社(昭和六十年三月十日までは日本トラベノール株式会社、同月十一日から昭和六十一年八月三十一日まではトラベノール株式会社、同年九月一日から昭和六十三年二月一日まではバクスター・トラベノール株式会社。以下同じ。)が昭和五十三年八月一日に薬事法第二十三条において準用する同法第十四条第一項の規定に基づく輸入販売承認を受けた非加熱濃縮血液凝固第VIII因子製剤ヘモフィルSについて、昭和五十八年一月から昭和六十年四月までの同法第四十三条第一項の規定に基づく検定の合格量は別表第六のとおりである。また、昭和六十一年五月以後に検定に合格したものは無い。なお、昭和五十七年以前の合格量については、記録が無いため不明である。
バクスター株式会社が昭和五十五年三月四日に薬事法第二十三条において準用する同法第十四条第一項の規定に基づく輸入販売承認を受けた非加熱濃縮血液凝固第VIII因子製剤ヘモフィルHについて、昭和五十八年一月から昭和六十年六月までの同法第四十三条第一項の規定に基づく検定の合格量は別表第七のとおりである。また、昭和六十一年七月以後に検定に合格したものは無い。なお、昭和五十七年以前の合格量については、記録が無いため不明である。
バクスター株式会社が昭和五十八年五月二十三日に薬事法第二十三条において準用する同法第十四条第一項の規定に基づく輸入販売承認を受けた非加熱濃縮血液凝固第IX因子製剤プロプレックスについて、昭和五十八年八月から昭和六十一年十一月までの製造量(自家試験合格量)は別表第八のとおりである。また、昭和六十一年十二月以後に製造したものは無い。なお、昭和五十八年七月以前の製造量については、記録が無いため不明である。
株式会社ミドリ十字が昭和五十三年八月一日に薬事法第十四条第一項の規定に基づく製造承認を受けた非加熱濃縮血液凝固第VIII因子製剤コンコエイトについて、昭和五十四年から昭和六十年までの販売量は別表第九のとおりである。なお、月ごとの販売量については、記録が無いため不明である。
株式会社ミドリ十字が昭和五十三年八月一日に薬事法第二十三条において準用する同法第十四条第一項の規定に基づく輸入販売承認を受けた非加熱濃縮血液凝固第VIII因子製剤プロフィレートについて、昭和五十四年から昭和五十九年までの販売量は別表第十のとおりである。なお、月ごとの販売量については、記録が無いため不明である。
株式会社ミドリ十字が昭和四十七年四月二十二日に薬事法第二十三条において準用する同法第十四条第一項の規定に基づく輸入販売承認を受けた非加熱濃縮血液凝固第IX因子製剤コーナインについて、昭和五十二年の販売量は別表第十一のとおりである。なお、月ごと及び昭和五十一年以前の販売量については、記録が無いため不明である。
株式会社ミドリ十字が昭和五十一年十二月二十七日に薬事法第十四条第一項の規定に基づく製造承認を受けた非加熱濃縮血液凝固第IX因子製剤クリスマシンについて、昭和五十二年から昭和六十一年までの販売量は別表第十二のとおりである。なお、月ごとの販売量については、記録が無いため不明である。
血友病の患者の血液凝固因子製剤の使用量を把握することが困難であるので、血液凝固因子製剤の供給量の変化を注視することだけでは、血友病の治療以外にも血液凝固第眠因子製剤が使用されていることを推測することは困難であった。
なお、血液製剤の製造量及び輸入販売量については、厚生省は社団法人日本血液製剤協会から報告を得ている。
御指摘の研究班は、エイズの対策の前提となる医学的知見を得るため、日本におけるエイズ患者の実態把握に関する研究、エイズ診断基準の設定に関する研究及び血液製剤に関する研究の三点を課題とする学術的な研究報告を目的として設置されたものである。
御指摘の研究班の人選において、血液及び血友病の権威が含まれているのは、血液又は血液製剤によるエイズの伝播の可能性が示唆されていたことによるものであると承知しており、当時の厚生省薬務局生物製剤課長によれば、安部氏が班長であったのは、その者が研究班の中で年配者であったこと等によるものであり、御指摘のような働きかけはなかった。
「AIDS抗体検査結果の取り扱いについて」(昭和六十一年四月二十六日付け健医感発第三十三号厚生省保健医療局結核難病感染症課感染症対策室長通知)及び「AIDS患者発生時等における留意点について」(同年五月一日付け健医感発第三十五号同室長通知)において、エイズ患者に対しては医師が病名を告知することを原則とすることを明示し、これらの通知を行ったことについて同年六月十二日のAIDS調査検討委員会に報告している。
厚生省において御指摘の者に対して事情聴取を行ったところ、「東北地区の治療医に対し、HIV救済制度の説明を行うことを目的として、東北大学に出向いたところ、同大学の医師に血友病患者及び患者の家族が集まっている会場に案内され、その場で突然同医師からここに参加されている方々はエイズウイルスに感染している旨の話が行われた。」との回答があった。
医師によるエイズウイルス感染者に対する告知は、本人の心理状態等に十分配慮して慎重に行うべきであり、また、プライバシーへの配慮が必要であると考えている。
厚生省としては、エイズウイルス抗体検査は本人の同意を得て行うことが原則であり、陽性者に対しては、二次感染の予防及び治療の促進の観点から、抗体陽性であることを告知することが原則であると考えており、この旨について、「AIDS抗体検査結果の取り扱いについて」、「AIDS患者発生時等における留意点について」、「AIDS感染予防に関する留意点について」(昭和六十二年二月二十六日付け健医感発第十四号厚生省保健医療局結核難病感染症課感染症対策室長通知)、「医療機関におけるエイズ診療体制について」(平成二年八月三十日付け健医感発第五十八号同局疾病対策課結核・感染症対策室長通知)、「HIV検査の実施について」(平成五年七月十三日付け健医感発第七十八号同局エイズ結核感染症課長通知)等により都道府県等を通じて医師に対する周知を図っているところである。
血液製剤によりエイズウイルスに感染した者については免疫能力が低下している者に対して、免疫不全の状態に応じ、エイズ発症予防のための健康管理費用を支給するとともに、エイズを発症した者に対し、血液製剤を供給する製薬企業の社会的責任に基づき特別手当等の支給を内容とする救済事業が実施されている。
なお、血友病患者については、先天性血液凝固因子障害治療研究事業により、医療保険制度による患者の自己負担部分について公費負担を行っているが、この事業は、血友病という疾患に着目し、血友病患者の身体的及び心理的負担を軽減するために実施しているものであり、血友病以外のエイズウイルス感染者を対象とすることは困難である。
厚生省としては、エイズ対策の推進を重要課題と考えており、平成八年度予算においては特に医療体制の充実及びエイズ医薬品等の研究開発の推進を図るため必要な経費を重点的に計上しているところである。
後天性免疫不全症候群の予防に関する法律は、医師と感染者との信頼関係に基づく医師の指導による感染防止を基本とし、エイズ患者等の人権保護を徹底しつつ、エイズの予防に必要な内容を規定しており、見直しは考えていない。
濃縮血液凝固因子製剤によるエイズウイルス感染については、当時エイズは血液及び血液製剤によって伝播することが示唆されていたが、その一方で、濃縮血液凝固因子製剤は、血友病の治療に不可欠であり、安定的な供給を確保することが強く求められていた。
こうした状況の中で、厚生省としては、「エイズのハイリスク者から供血されたものでない」旨の証明書を製剤及び原料に添付するよう製薬企業に対して指示し、及び加熱濃縮血液凝固因子製剤の承認申請について、臨床試験の症例数を必要最小限とする等の措置を講じたが、和解勧告に当たって裁判所から示された所見にもあるように、血液製剤を介して伝播されるウイルスにより国内の血友病患者がエイズに罹患する危険性やエイズの重篤性についての認識が十分でなく、期待された有効な方策を十分講ずることができず、被害の拡大を防ぐことができなかったものと考えている。
別表第一(非加熱血液凝固第VIII因子製剤コンファクト8)

別表第二(非加熱血液凝固第VIII因子製剤ハイクリオ)



別表第三(非加熱血液凝固第IX因子製剤PPSB ― ニチヤク)



別表第四(非加熱血液凝固第VIII因子製剤コーエイト)

別表第五(非加熱血液凝固第IX因子製剤コーナイン バイエル薬品株式会社)

別表第六(非加熱血液凝固第VIII因子製剤ヘモフィルS)


別表第七(血液凝固第VIII因子製剤ヘモフィルH)



別表第八(血液凝固第IX因子製剤プロプレックス)
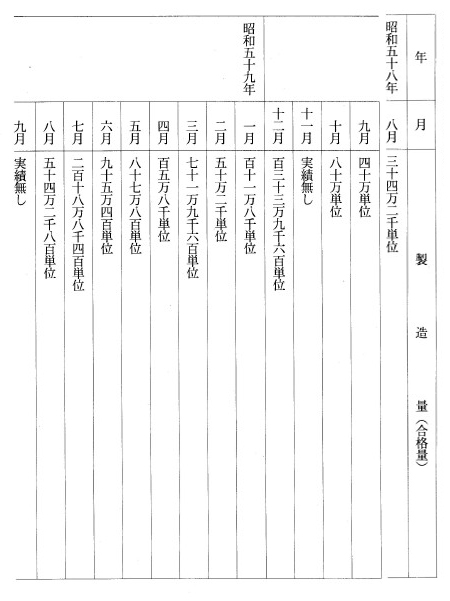


別表第九(血液凝固第VIII因子製剤コンコエイト)

別表第十(血液凝固第VIII因子製剤プロフィレート)

別表第十一(血液凝固第IX因子製剤コーナイン 株式会社ミドリ十字)

別表第十二(血液凝固第IX因子製剤クリスマシン)



