����{�����
�����\�Z�N�����ܓ���o�����l�Z��
�l�l�q���N�`���ƍ��̑Ή��Ɋւ��鎿���ӏ�
��o�ҁ@�@�����m�q
�l�l�q���N�`���ƍ��̑Ή��Ɋւ��鎿���ӏ�
�@��Z�Z��i������l�j�N�����O����i��ӏ���Ƃ����j�A����ꌎ�����i��ӏ���j�̎���Ɉ��������A��Z�Z�l�i������Z�j�N�l����ܓ��i��ӏ��O�j�A���N�Z����ܓ��i��ӏ��l�j�̎���ɂ����Ă��Ȃ��ۑ肪�c�铚�قł������B����Ă���ɂl�l�q���N�`���ɂ�镛��p��Q�����Ɋւ���^���̉𖾂ƍ���̗\�h�ڎ�s���y�іs���ɂ�������S���m�ۂ�M�����̌��������Ĉȉ��̎��������B
��@�������N��ꔪ���ɊJ�Â��ꂽ�����R�c������ܒ�����ɒ�o���ꂽ�ǐ������܉ۂ̎����ɂ���u���i�̗L�����̌��E�߂��Ɉʒu�v�̔F���ɂ��ẮA������������̂��߂Ɏ��₷��R�c��ɑ��A��b�����݂̂Ȃ炸�l�l�q���N�`���̈��S���������͗L�����Ɋւ��āA�ǂ�����̔F�������������Ƃɓ��ǂ̐[���ȑ��������f�킹����̂ł���B���邢�͂��̎����܂łɖǂ͂l�l�q���N�`���̎g�p�����킹��I����������ɌX���Ă����ƍl�����邪���{�̌����͂��������B
�O�@�������N�l���l�l�q���N�`�������ɂ�����A�u�ی�҂���]�����ꍇ�g�p���邱�Ƃ��ł���v�Ƃ��ꂽ�B�������A���{���Ύs�̍L�������N�O�����i��ӏ��O�ʎ��j�ɂ��A�u�͂������N�`������l�l�q���N�`���ɐ�ւ����v�ƋL�ڂ���Ă��邱�Ƃ��炵�āA���Ύs���ɂƂ��đI���̗]�n�Ȃ��l�l�q���N�`�����������ꂽ�̂ł���A�ގ��̎��Ԃ͑��̎����̂ł��������݂������Ƃ��A��ӏ��O�ւ̓��قɂ�薾�炩�ɂȂ����B����ɂ��Ɖ����O�A��܈�̂����������L���c���Ă����O�Z��̂����̈��Z�s�撬���ɂ����č��Ύs�Ɠ��l�ł������B����ɐ��m�ɒ������s���Ζc��Ȑ��ɂȂ�ƍl������B���́A�@�߂ɔ�����A������l�l�q���i��Q�҂𑝂₵������Ƃ�������B�Ȃ����̂悤���ꗂ����������̂��A�����ɍۂ��Č����Ȃ��s���{����ʂ��Ďw���������e�𖾂炩�ɂ�����Ő��{�̌������q�ׂ�B
�l�@���̎l�̒ʒm���ɂ��āA�����̊e���ɂ��ē��ق����߂�B
�@�i��j�@���a�Z�\�O�N�\�\����t�A���㔭���l�O�O���e�s���{���m�����Č����ȕی���Ëǒ��ʒm�u�\�h�ڎ���{�K���̈ꕔ����������ȗ߂̎{�s���ɂ��āv�́u���@�\�h�ڎ���{�K���̈ꕔ�����Ɋւ��鎖���@�P�@������̗\�h�ڎ�̎��{���@�����̂悤�ɉ����������Ɓi������W�j������̒���̗\�h�ڎ�ɓ����āA�����ɕ�����y�т����ӂ������̗\�h�ڎ����|�̐\���o�������҂ɂ��ẮA������Ő��������ӂ��������������N�`�����g�p���邱�Ƃ��ł��邱�ƂƂ��邱�ƁB�v
�@�i��j�@���a�Z�\�O�N�\�\����t�A���㊴�����O���e�s���{���q����Ǖ��i�ǁj�����Č����ȕی���Ëǎ��a��ی��j�E�����Ǒ��ʒm�u������Ő��������ӂ��������������N�`���̐ڎ�ɂ��āv�́u���@�ڎ�ɓ������Ă̗��ӎ����@�P�@����̉����͖����N�`���ɕ�����y�т����ӂ������̃��N�`���������������N�`�����J�����ꂽ�̂Ŗ�����̐ڎ�̂Ƃ��ɂ������]�҂ɂ͎g���Ă��悢���ƂƂ�����̂ł��邱�ƁB�v
�@�i�O�j�@�������N���������t�A�����ȕی���Ënj��j�E�����Ǒ\�h�ڎ�W����e�s���{���\�h�ڎ�S���҂��Ď����A���u�\�h�ڎ���{�K���̈ꕔ����������ȗ߂̎{�s���ɂ��āv�́u�P�@������̗\�h�ڎ�ɓ������āA�����ɕ�����y�т����ӂ������̗\�h�ڎ����]����|�̐\���o���������҂ɂ��ẮA������Ő��������ӂ��������������N�`�����g�p���邱�Ƃ��ł��邱�ƂƂ������ƁB�v
�@�i�l�j�@�������N�\��\�����t�A���㊴������e�s���{���q����Ǖ��i�ǁj�����Č����ȕی���Ëǎ��a��ی��j�E�����Ǒ��ʒm�u������Ő��������ӂ��������������N�`���̐ڎ�ɂ��āv�́u���̓x���O�q���R�c��`���a�\�h������ʓY�̂Ƃ���ӌ����o���ꂽ�̂ŁA����Ɋ�Â��A������Ő��������ӂ��������������N�`���i�ȉ��u�l�l�q���N�`���v�Ƃ����B�j�̎g�p�Ɋւ��A�����S�ȃ��N�`�����J�������܂ł̊ԁA�ی�҂���̐\���o���������ꍇ�Ɍ���A������̒���̗\�h�ڎ펞�ɂl�l�q���N�`�����g�p���邱�ƂƂ����̂ŁA���㉺�L�����𗯈ӂ̏���{���ꂽ���B�v�u�P�@������̒���̗\�h�ڎ펞�ɂ͖����N�`�����g�p���邱�Ƃ������Ƃ��邪�A�ی�҂���̐\���o�ɂ��l�l�q���N�`�����g�p�����ꍇ�ɂ��A�\�h�ڎ�@��̎�舵���́A�]���ʂ薃���N�`�����g�p�����ꍇ�Ɠ��l�Ƃ��ꂽ���B�Q�@�l�l�q���N�`���̌��ʁA�������ɂ��Ď��m��}�邽�߁A�ʎ��w�l�l�q���N�`���̐ڎ�ɂ��āx�̓��e��ی�҂Ɏ��O�Ɏ��m���邽�߂̍L�����s���悤�M�lj��s�������w�����ꂽ���B�܂��A�\�h�ڎ�@�ɋK�肳�ꂽ�\�h�ڎ�@�ɂ�錒�N��Q�ɑ���~�ϐ��x�ɂ��Ă��A���m���}����悤�M�lj��s�������w�����ꂽ���B�R�@�ی�҂ɂl�l�q���N�`���̐ڎ�@�����邽�߁A��t��W�@�ւƋ��c���A�l�l�q���N�`���ڎ�����{�����Ë@�ւ��ł��邾�������m�ۂ����悤�A�M�lj��s�������w�����ꂽ���B�v
�@�E�̎l�̒ʒm���ɂ��āA�ȉ��Ɏ��₷��B
�@�A�@�i��j�A�i��j�̒ʒm���o���ꂽ��A�ڎ킪�J�n����Ă��鎵���ɂȂ��āi�O�j�̎����A�����o�������Ƃ̈Ӗ��͉����B���̎��_�܂łɗ\�����ʕ���p�̕��Ă����̂Ɂu�ϋɐ��i�v�̕��j�ɗh�炬���������ł͂Ȃ��̂��B���������́A�����Ȃ���������莀�S��̕������ł���B�l�l�q���N�`���ڎ��̕���p���邢�ُ͈�ȏǗ�ɂ��čŏ��̕����̂͂��ł���A�ǂ̂悤�ȓ��e�i�ڎ�N�����A�s���{���A�f�f�����j�ł��������𖾂炩�ɂ��������Ő��{�������q�ׂ�B
�@�C�@�܂��A�i��j�A�i��j�A�i�O�j�͂Ƃ��ɖ����N�`���ڎ�������Ƃ��Ă���̂ł���A�i�l�j�̂P�̓��e�͊�{�I�ɓ����ł���A�������Ċm�F�����ɂ����Ȃ��Ɨ�������A�i�l�j�́A�i��j�ɑΉ����錋�j�E�����Ǒ��ʒm�ł���A�i��j�̕ی���Ëǒ��ʒm�Ɏ����ꂽ���j�ɕύX����������̂ł͂Ȃ��ƍl�����邪�A���{�����͂��������B
�܁@�����Ȃ͂l�l�q���N�`�����{�̑S���Ԃɂ����āA���R���������ӂ������̖��ې��������Ƃl�l�q���N�`����̂���ɂ��Ĕ�r���A�]�����������������̍l�����͌��ł���B�͂����P�����N�`���̕���p�����̏Ƃl�l�q���N�`���ڎ��̏��r���āA�l�l�q���p�����邩�A�͂����P�����N�`���ɖ߂������������邱�Ƃ����Ó��������Ƃ�����B�����Ė��ې��������Ƃ������X�N����������ŗ\�h�ڎ�@�̑Ώێ��a�ł͂Ȃ������ӂ��������l������K�v�͂Ȃ��̂ł���B���{�̌����͂��������B�܂��A���L�O���ɂ��ē��ق����߂�B
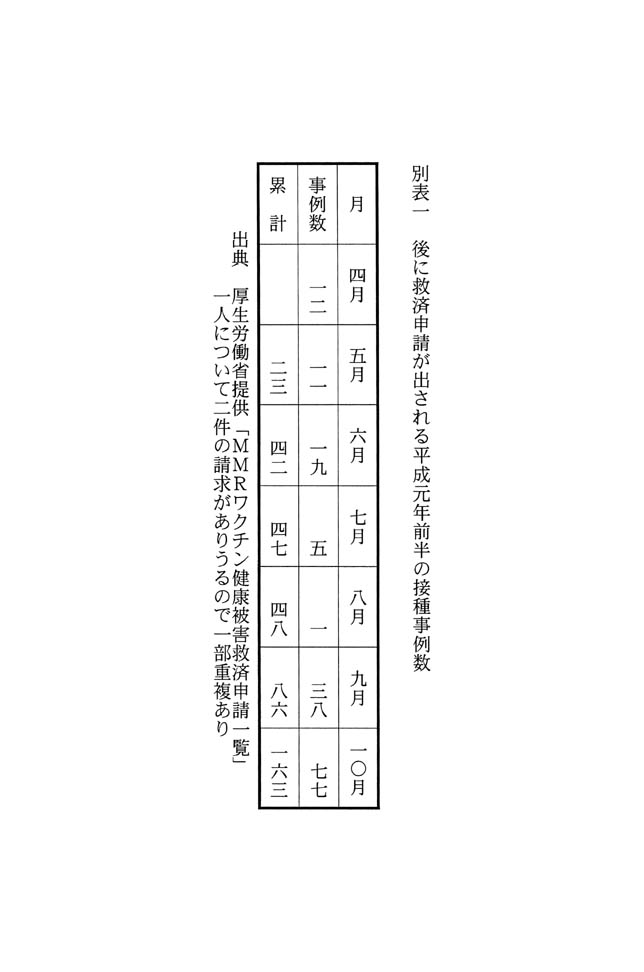
�@�i��j�@�@���a�Z�O�N���܂ł́u�͂������N�`����ڎ�ґ����ƔF���Q�Ґ��v�A�y�чA������ܔN���܂ł́u�͂������N�`����ڎ�ґ����ƔF���Q�Ґ��v�A�B�������N�㌎���܂ł́u�l�l�q��ڎ�Ґ��ƔF���Q�Ґ��v�A�y�чC������ܔN���܂ł́u�l�l�q��ڎ�Ґ��ƔF���Q�Ґ��v����������ŁA�����̐��l����͂������N�`���Ƃl�l�q���N�`���̈��S�����r���A����ɂ��Č����J���Ȃ̌������q�ׂ�B
�@�i��j�@�{��ӏ��O���l�Ɏ������ʒm�i�l�j�̂Q�ł����ʎ��u�l�l�q���N�`���ɂ��āv�̋L�q�ɂ́A�͂������N�`���Ƃl�l�q���N�`���̈��S���̔�r�Ɋւ�����͈̂�Ȃ��A�ނ��뎩�R�����̂����ӂ������̋��Ђ��������A���S���ɋ����^�������������l�l�q��̕���p���ߏ��ɕ]�����A�������ɂ��l�l�q�ڎ�������߁A������U�����Ă���Ɨ�������邪���{�����͂��������B
�@�i�O�j�@�ڂ������l�͖{���i��j�ւ̓��قɑ҂Ƃ��āA�����ܔN�����݂̗\�h�ڎ팒�N��Q�F��ҁi�w����l�N�����q���̓����x�ɂ��j�̓��A�����N�`���ɂ����̂��ܓ�l�i������͏��a�O�N�����j�ł���A�{��ӏ��ʕ\��ɂ��镽�����N�������܂ł̐ڎ�Ŏl���l�A�㌎���܂ł̐ڎ�Ŕ��Z�l�̔�Q�F�肪���邱�Ƃ��炵�āA�l�l�q�ɂ���Q�F��̌��ʂ���ސ�����ɁA�x���Ƃ��㌎�i�K�ł͂l�l�q�ڎ�̊댯����������P���ڎ�̂����傫���������Ƃ�����B�ɂ�������炸�\�h�ڎ�@�̑Ώێ��a�ł͂Ȃ������ӂ������ɌŎ����A�l�l�q�ڎ�ɂ�������Q���g�債�������̂͂Ȃ����B��A�Z�l�Z�l�̔�Q�҂��o���Ă��Ȃ������ӂ���������u����K�v�Ɩ@�I�������ǂ��ɂ������̂��A���̗��R���q�ׂ�B
�Z�@��ӏ��O�ւ̓��قɂ����āA�Вc�@�l�k���������y�ѕ��c��i�H�Ɗ�����Ђ̂l�l�q���N�`���ɂ��ẮA�u���i�̐������̏��F�̐����ɂ��āv�i���a�l�\�Z�N�Z����\����t����ܕS���\���������Ȗǒ��ʒm�j�Ɋ�Â����F�������@�l��������J����b�֕Ԕ[����Ă���Ƃ̓��قł��������A���́u�Ԕ[�v�Ƃ͂��̂��Ƃł��邩�B���m�ɓ��ق���B
���@������ܔN��Z���Ɋ��s���ꂽ�ؑ��O���v�E��t���E���R�@�G�ҁw�\�h�ڎ�̎�������Łx�ɂ��ƁA���ݏ��F�R�����Ȃ���Ă���č������N�А��l�l�q���N�`���i�\����Ƃ́i���j���w�y�ь����Ö@�������j�ɂ��āA�i��j�Y�����̉��ǂ��Ȃ���Ă��Ȃ��A�i��j���Y�̂͂����A�����ӂ������A�����N�`���������M�̓_�Ŋi�i�ɗ��A�i�O�j���Y�l�l�q�Ŗ��ɂȂ������ې��������ɂ��Č�����ɂ͗Տ������̐ڎ�ᐔ�����Ȃ��A�Ƃ���Ă���B���̒����̕Ҏ҂�́A���Y�l�l�q�̐��i�ɂ�����A���ɖؑ��A���R��͋��Ɍ��O�q���R�c��`���a�\�h����\�h�ڎ�ψ���邢�͒����R�c������ܒ�����ψ��̒��j�Ƃ��ď��F�E�����E���~�Ȃǂ̐���ɐ[���ւ�����l���ł���A�����Ȃ������e���͂������Ƃł���B�����N�А��l�l�q�̐R���ɂ�����E�̎w�E�͏d��ł���A�R���͐T�d�������ׂ��ƍl������B�E�̎w�E�ɂ��Đ��{�̌������q�ׂ�B
���@��ӏ��O�ւ̓��قɂ����āu���݂̈�w�I�m���ɂ����ẮA�l�l�q���N�`���̐ڎ�Ǝ��ǂƂ̊Ԃɂ͈��ʊW�͔F�߂��Ȃ����̂ƍl���Ă���B�v�Ƃ��邪�A�����J���Ȃ͂��ǂ̂悤�Ȃ������Łu���݂̈�w�I�m���v�̌������s�����̂��B
�@�܂��A�l�l�q��Q�҂ɂ��āu�V���ɒ������s���K�v�͂Ȃ��ƍl���Ă���B�v�Ɠ��ق���Ă��邪�A��Q�҉Ƒ�����w��̘_���܂��Ďq���̊ώ@���ł���͂��͂Ȃ��A�V���ȋ~�ϐ\���ɂ���Q�҂̗\�オ�c���ł���ȂǂƂ����l�����͘_�O�ł���B���܂��ɕč����l�l�q�����F����悤�Ƃ��A���łɈꕔ���Ƃ͂���ɂ��͂�������Ă��Ă��錻��ɂ����āA��A�Z�l�Z�����̔�Q�F����s�������́A�\���҂̃J���e�i���ɍ��͔p�������Ƃ��Ă��s���{���E�s�撬���ɂ͕ۊǂ���Ă���j�̌����ƁA��Q�Җ{�l�̗\��ɂ��ĒǐՒ��������邱�Ƃ��K�v�ƍl����B�������N�����ڎ�Ŗ��ې��������Ə����Ж�Ⴢ̔�Q�F�肪�Ȃ���A���̎��N��̕������N�Z���ɏ�Q���{��N�����F�肳�ꂽ����i��ӏ���ւ̓��ق��j�͔�Q�҂̒����\��ɒ��ڂ��ׂ����Ƃ��������Ă���B�܂��A������ܔN��ꌎ��Z���̎��a�E��Q�F��R������ǁE�\�h�ڎ�R�����ȉ�ɂ����āA�l�l�q�̔�Q���ꌏ�F�肳��Ă���i�ڍׂ͕s���j���Ƃ����l�Ƃ�����B�\�h�ڎ�@�ɋK�肳�ꂽ��Q�҂ւ̕ی��������Ƃ̊ϓ_�y�э���ɐV���Ȕ�Q�������Ȃ����߂ɁA����ɂ͗\�h�ڎ�s���A�s���ւ̐M�������m�ۂ����ł���Q�҂̒����\��⎩�ǂɊւ��钲���ɂƂ肭�ނׂ��ƍl���邪���{�������q�ׂ�B
��@�����J���Ȃ���������̂l�l�q���N�`���̐����@�ꕔ�ύX�Ɋւ���@�ᔽ�̋^���������@�͉����A���N���ǂ̂悤�ɔ��f���A�������蒲���ɂ�����̂���������B
��Z�@���͎�ӏ���ւ̓��ُ��ȗ������ŁA�l�l�q���N�`���Ɋւ��āA�u�����K�ȍs�����f�����Ă��Ă���v�Əq�ׂĂ��邪�A��A�Z�l�Z�Ƃ�����Q�F��Ґ�����A�s�K�Ȕ��f���J��Ԃ������Ƃ͖����ł���B���a��O�N�\�h�ڎ�@����{�s�ȗ��̗\�h�ڎ�ɂ����Ĕ���������Q�ɂ��āA�l�l�q��Q�F��Ґ��̑S�̂ɐ�߂銄�����ǂ�قǂ��������A�l�l�q���N�`���ɂ�镛��p�������ʂ̔F���Q�҂ݏo�������Ɋւ��A�ǂ��ɖ�肪�������̂����ʓI�ɕ��́E�]�������ĐӔC�̏��݂𖾂炩�ɂ���B
�@�E���₷��B