答弁本文情報
平成十四年九月十日受領答弁第一九〇号
内閣衆質一五四第一九〇号
平成十四年九月十日
衆議院議長 綿貫民輔 殿
衆議院議員阿部知子君提出MMRワクチン接種による被害発生の原因究明に関する質問に対し、別紙答弁書を送付する。
衆議院議員阿部知子君提出MMRワクチン接種による被害発生の原因究明に関する質問に対する答弁書
一について
乾燥弱毒生麻しんおたふくかぜ風しん混合ワクチン(以下「MMRワクチン」という。)の接種後の無菌性髄膜炎の発生については、平成元年九月ごろには新聞等により報道されていたことから、厚生省においても情報収集に努めていたところであり、前橋市における状況については、同年十月二十五日の公衆衛生審議会伝染病予防部会予防接種委員会において、前橋市医師会から、同年四月から同年八月までの間の被接種者は千八百三十四人であり、無菌性髄膜炎の発症者は十人であると報告されている。
なお、御指摘の二百十七人に一人という無菌性髄膜炎の発生割合については、社団法人日本感染症学会が平成二年三月二十日に発行した「感染症学雑誌」第六十四巻臨時増刊号に掲載されたものであると思われるが、厚生省がこのような数値を把握した時期は特定できていない。
御指摘の事例については、平成元年五月九日にMMRワクチンの接種を受けた者が、同月十六日に急性心不全により死亡した旨の連絡を、同年七月七日に福島県から受けている。また、平成二年一月八日に被接種者の保護者が予防接種法(昭和二十三年法律第六十八号)に基づく死亡一時金及び葬祭料を請求し、平成四年三月三十日付けの厚生大臣による認定を経て、同年五月二十五日に死亡一時金及び葬祭料の給付決定が行われている。
カナダにおけるおたふくかぜワクチン(MMRワクチンを含む。)の接種後の無菌性髄膜炎の発生状況については、平成元年十一月一日付けで厚生省薬務局長から外務省北米局長に対して調査を依頼し、カナダ在外公館を通じて、次の情報を得たところである。
1 占部株から製造されたおたふくかぜワクチンが含有されたMMRワクチンであるトリビリックスについては、接種後四週間以内に八例の無菌性髄膜炎患者が観察されたこと、当該無菌性髄膜炎患者の脳脊髄膜液からおたふくかぜウイルスが検出されたこと、接種後四週間以内に高頻度でおたふくかぜが発生していたこと等の理由により、カナダ厚生省は、製造業者及び販売業者(以下「製造業者等」という。)に対してトリビリックスの製造及び販売の中止を要請し、製造業者等は昭和六十二年十一月以降自主的にその製造及び販売を中止している。
なお、昭和六十三年十一月十九日付けのカナダ政府の疾病週報によれば、当該無菌性髄膜炎患者は、いずれも入院期間は短く、完全に回復したと報じられている。また、平成五年に提訴されたMMRワクチンの採用等に関する国家賠償請求訴訟の過程で原告側がカナダ政府担当者に確認したところ、自主的なその製造及び販売の中止は、昭和六十三年以降に行われたとのことである。
2 その後、カナダ政府による実験で得られたデータによれば、トリビリックスの接種後に無菌性髄膜炎を発症した患者から検出されたおたふくかぜウイルスの核酸塩基配列が、トリビリックスに使用されているおたふくかぜウイルスのものと同一の部分が多いことが確認された。このため、カナダ厚生省は、無菌性髄膜炎の発症とトリビリックスの接種との間には関係があると結論付けている。
また、厚生省においてカナダにおけるトリビリックスの自主的な製造及び販売中止に関する正確な情報を入手した時期は不明であるが、平成元年十月二十五日の中央薬事審議会生物学的製剤特別部会生物学的製剤調査会においては、占部株から製造されたMMRワクチンの自主的な製造中止について審議が行われていることから、遅くとも同調査会の開催時には、何らかの情報が入手されていたと推測される。
なお、外国における医薬品の製造中止等の措置に関する情報の入手方法については、平成九年四月以降は、薬事法施行規則(昭和三十六年厚生省令第一号)第六十四条の五の二の規定により、医薬品の製造業者等は、同一成分を有する医薬品に関する外国での製造中止等の保健衛生上の危害の発生又は拡大を防止するための措置の実施を知ったときは、厚生省に報告することとなったが、カナダにおいてトリビリックスの自主的な製造及び販売の中止が行われた当時は、このような報告制度はなく、厚生省がこのような外国における情報をどのように入手したかは不明である。
御指摘の通知は、平成元年十月二十五日の公衆衛生審議会伝染病予防部会予防接種委員会で取りまとめられた意見を踏まえて、発出されたものである。
同委員会の意見は、MMRワクチン及びおたふくかぜワクチンの接種後の無菌性髄膜炎の発生状況に係る都道府県からの報告の中には、ワクチン由来とは考えにくい症例も含まれていることから、至急PCR法によるスクリーニング検査等を行うことにより正確な発生頻度を把握し、その結果を踏まえて当面の措置を検討する必要があり、その結果が判明するまでの間は、麻しん及びおたふくかぜの流行が共に収まりつつあることを勘案しつつ、MMRワクチンの接種を慎重に行う必要があると思われるとの内容であった。
これを受けて、「乾燥弱毒生麻しんおたふくかぜ風しん混合ワクチンの接種について」(平成元年十月二十五日付け健医感発第九十三号厚生省保健医療局疾病対策課結核・感染症対策室長通知)を各都道府県に発出するとともに、各地域におけるおたふくかぜの流行の状況を勘案し、麻しん単味ワクチン又はMMRワクチンの接種を引き続き行うよう指導したところである。
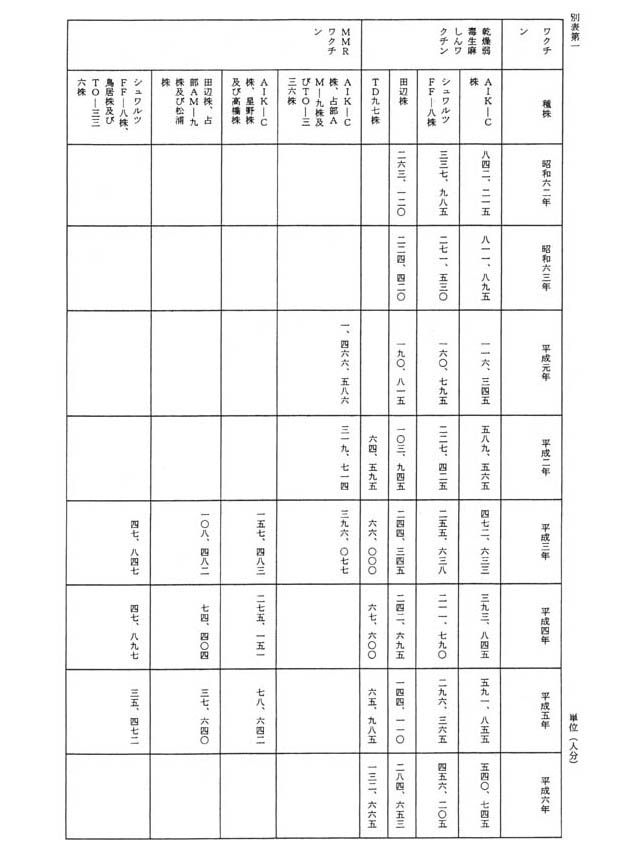
社団法人細菌製造協会からの報告によれば、昭和六十二年から平成六年までの各年における乾燥弱毒生麻しんワクチン及びMMRワクチンの製造量は、別表第一のとおりである。
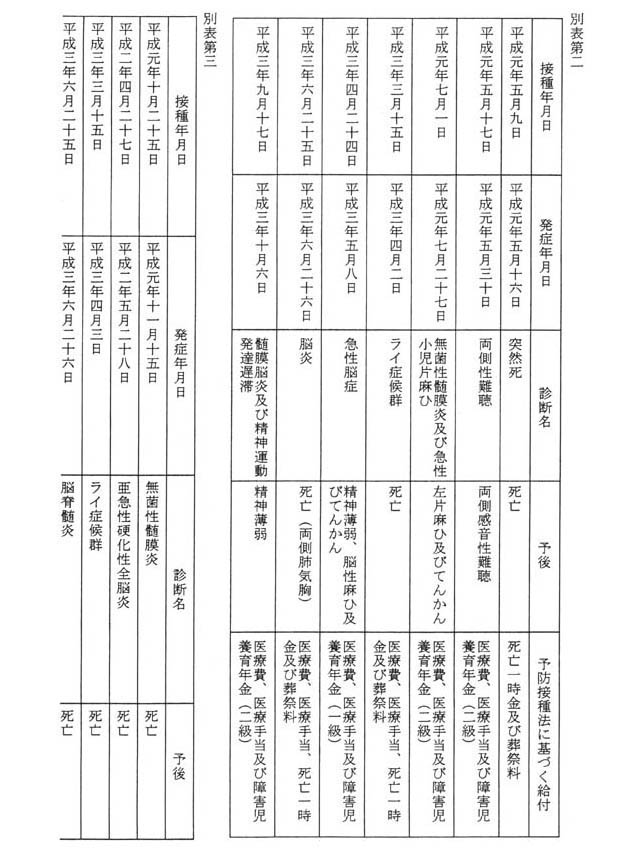
MMRワクチンの接種を行った後、当該接種により死亡し、又は障害の状態となり、予防接種法に基づく給付に係る厚生大臣の認定がなされたものとして厚生省保健医療局が把握している事例は七件であり、その詳細は別表第二のとおりである。
なお、お尋ねの事項のうち経過については、特定の個人が識別され、個人の権利利益が害されるおそれ等があるため、答弁を差し控えたい。
MMRワクチンの接種を行った後、当該接種により死亡し、又は障害の状態となったものとして厚生省薬務局が製造業者から報告を受けた事例は五件であり、その詳細は別表第三のとおりである。
なお、当該報告においては患者名が略名で表記されていることから、予防接種法又は医薬品副作用被害救済・研究振興調査機構法(昭和五十四年法律第五十五号)に基づく給付の請求の有無及び給付の内容は確認できない。また、お尋ねの事項のうち経過については、特定の個人が識別され、個人の権利利益が害されるおそれ等があるため、答弁を差し控えたい。
MMRワクチンは、一回の接種で麻しん、おたふくかぜ及び風しんの三疾病について免疫を付与することが可能であり、被接種者の肉体的、経済的及び時間的負担を軽減することができる点で、感染症対策上有意義であると考えられたことから、被接種者の保護者が希望した場合にはMMRワクチンの接種を受けることができることとしたものである。なお、MMRワクチンの接種後の無菌性髄膜炎の発生頻度は、おたふくかぜに自然感染した場合の無菌性髄膜炎の発生頻度よりも低いとされている。
昭和六十三年九月、三疾病とも全製造業者共通の統一株を用いて製造されたMMRワクチン(以下「統一株ワクチン」という。)及び統一株以前の自社株も用いて製造されたMMRワクチン(以下「自社株ワクチン」という。)の製造が共に承認されたが、統一株ワクチンについては、先に供給体制が整い、使用可能となったことから、平成元年四月から接種が開始され、自社株ワクチンについては、平成三年十月に供給体制が整い、使用可能となったことから、同月から接種が開始されたものであり、業界や専門家の意向については承知していない。
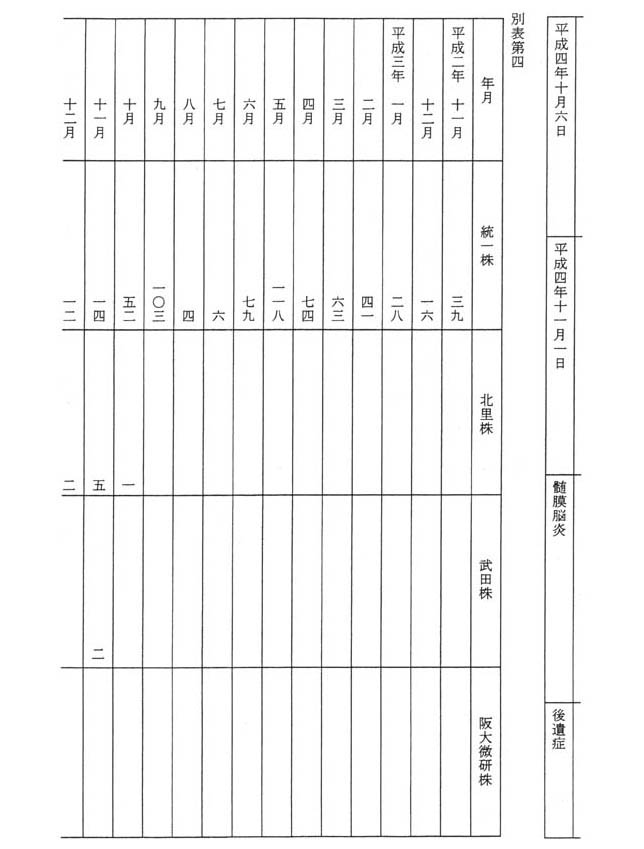
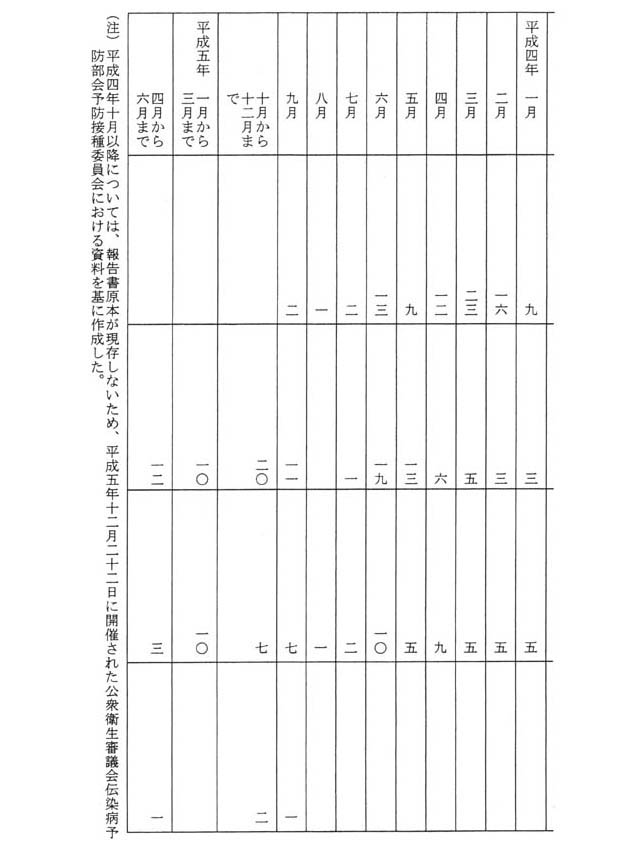
御指摘の通知に基づき、厚生省保健医療局は、平成二年十一月から平成五年六月までの間、MMRワクチンの接種後の無菌性髄膜炎の発生状況を把握していたところであり、MMRワクチンの接種後に無菌性髄膜炎を発症した者は、平成二年十一月及び十二月は五十五人、平成三年は六百四人、平成四年は二百二十七人、平成五年一月から同年六月までの間は三十六人であり、その月別及び株別の内訳は別表第四のとおりである。
統一株ワクチンと同時に製造が承認されていた自社株ワクチンについては、平成三年十月に供給体制が整い、使用可能となったことから、同月から接種が開始されたものであり、このことによって接種に当たってのワクチンの選択の幅が拡大されたと認識している。
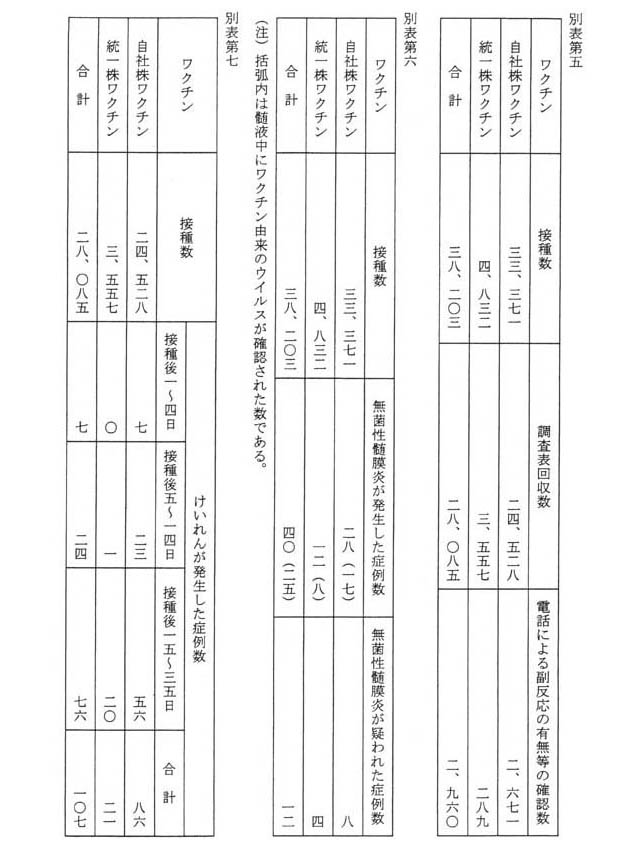
平成三年度から平成五年度までの間の厚生科学研究費補助金による「現行ワクチンの品質向上に関する研究」においては、全国約一万五千人の小児科医を対象としたアンケート調査が行われており、その回収状況等は別表第五のとおりであり、また、MMRワクチンの接種後の副反応の発生状況は、無菌性髄膜炎については別表第六、けいれんについては別表第七、発熱嘔吐については別表第八、耳下腺腫脹については別表第九のとおりであるが、都道府県別の内訳は不明である。
厚生省薬務局がMMRワクチンの安全性の確保に関して行った業務は、次のとおりである。
1 平成元年九月十一日の中央薬事審議会生物学的製剤特別部会生物学的製剤調査会において、MMRワクチンの有用性に疑いはなく、接種の必要性の判断に影響を与えるものではないが、使用上の注意の副反応の項にワクチン由来と疑われる無菌性髄膜炎が極めてまれに発生するとの報告がある旨の記載を行い、できるだけ早く関係者に知らせる必要があること、ワクチン由来が疑われる無菌性髄膜炎の症例調査を行い、その頻度及び症状の程度の正確な把握に努めること等が意見として取りまとめられたことを踏まえ、同月、製造業者等に対して、使用上の注意の副反応の項に、「おたふくかぜワクチンに由来すると疑われる無菌性髄膜炎が、極めてまれに(十万人から二十万人接種当たり一人程度)発生するとの報告がある」旨の記載を行うとともに、ワクチン由来が疑われる無菌性髄膜炎の症例調査を含め、市販後の監視を強化するよう指示した。
2 同年十月二十五日の同調査会において、MMRワクチンの接種後の無菌性髄膜炎の発生について審議した結果、ワクチン由来の無菌性髄膜炎の正確な発生頻度が把握され、諸外国の状況が判明した段階で同調査会を開催し、今後の対策を検討することとされたため、諸外国の状況を把握するため、外務省に対し調査を依頼した。
3 同年十二月十八日の同調査会において、おたふくかぜに自然感染するリスクとMMRワクチンの接種後に無菌性髄膜炎を発症するリスクとを比較するとともに、MMRワクチンの海外における医学的知見、使用状況等を検討した結果、MMRワクチンの医薬品としての有用性は認められるが、無菌性髄膜炎の発生に関する使用上の注意を改訂し、注意喚起を行うとともに、ワクチン由来の無菌性髄膜炎の正確な発生頻度を把握するため、市販後の監視を強化すべきであるとの意見が取りまとめられた。これを踏まえ、平成二年一月十八日、製造業者等に対して、使用上の注意の副反応の項における記載を「接種後三週間前後に、おたふくかぜワクチンに由来すると疑われる無菌性髄膜炎が数千人接種当たり一人程度発生するとの報告がある」と改めるよう指示するとともに、その内容を同年三月の「医薬品副作用情報」に掲載し、関係者への周知を図った。
4 平成三年八月には、製造業者等に対して、使用上の注意の副反応の項において接種後ワクチンに由来すると疑われる無菌性髄膜炎がまれに発生するとの報告がある旨を明記し、統一株MMRワクチンに係る無菌性髄膜炎の発生頻度を「千二百人接種当たり一人程度」と改めるよう指示するとともに、これらの内容を同年十一月の「医薬品副作用情報」に掲載し、関係者への周知を図った。
なお、当時、厚生省薬務局は、おたふくかぜワクチン(MMRワクチンを含む。)の製造業者から、接種後の無菌性髄膜炎に関する調査報告を求めるとともに、同省保健医療局から、各都道府県が無菌性髄膜炎の発生頻度について行った調査に関する情報を入手していた。
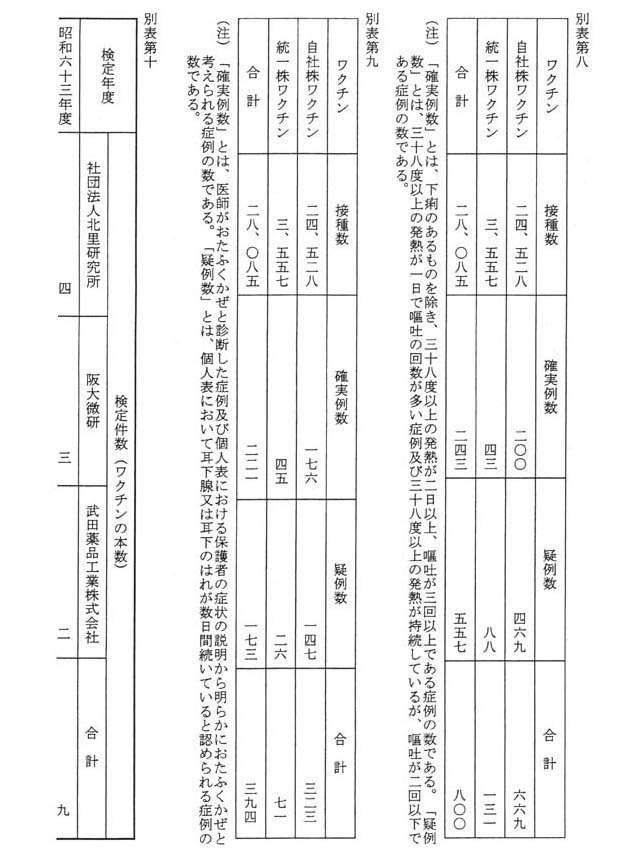
昭和六十三年から平成五年までの間、社団法人北里研究所、財団法人阪大微生物病研究会(以下「阪大微研」という。)及び武田薬品工業株式会社から、MMRワクチンについて合計七十九件の検定申請があり、そのすべてが検定に合格している。製造業者別及び年度別の申請件数及びワクチンの本数は、別表第十のとおりである。また、MMRワクチンの検定項目は、含湿度試験(検体中に含まれる水分量を測定するための試験)、無菌試験(検体中に含まれてはならない微生物が存在しないことを確認するための試験)及び力価試験(ワクチンの有効性を確認するための試験)である。
阪大微研は、平成元年一月、おたふくかぜワクチン原液の製造方法を、細胞培養法のみにより製造する方法から細胞培養法及び羊膜培養法により製造した各原液を混合する方法へと変更するに当たって、薬事法(昭和三十五年法律第百四十五号)上の一部変更承認の手続を怠っていた。
阪大微研がこのような製造方法の変更を行った後におたふくかぜウイルス占部株を基に製造したMMRワクチンと副反応の発現の関連性等の技術的問題については、平成六年二月二日の中央薬事審議会生物学的製剤特別部会においても審議されたが、製造方法の相違によるおたふくかぜウイルスの性状の相違は見られず、また、おたふくかぜウイルスによる無菌性髄膜炎の発生の機序を解明するには至っていないと結論付けられており、阪大微研による製造方法の無断変更と副反応との因果関係は不明である。
米国製のMMRワクチンについて、薬事法に基づく輸入販売の承認申請が行われた場合は、臨床試験の成績等に基づき、当該MMRワクチンの品質、有効性及び安全性を厳密に審査した上で、承認の可否を決定することになると考えている。
ポリオワクチン及びジフテリア百日せき破傷風混合ワクチン(以下「DPTワクチン」という。)に関するお尋ねの事項は、次のとおりである。
1 ポリオワクチンについて
平成十二年五月十五日、福岡県及び財団法人日本ポリオ研究所から、因果関係は不明であるが、同一ロットのポリオワクチンの接種後に無菌性髄膜炎を発症し、その後下肢麻ひ又は急性脳症となった症例がそれぞれ一例ずつ発生したため、福岡県におけるポリオワクチンの接種を中止したとの報告があった。
これを受けて、安全性の確保の観点から因果関係の調査等を行うため、「ポリオワクチンの予防接種の実施の見合わせについて」(平成十二年五月十六日付け医薬安第六十八号厚生省医薬安全局安全対策課長通知・医薬血第二十九号同局血液対策課長通知・健医感発第四十五号同省保健医療局結核感染症課長通知)を発出するとともに、各都道府県にこれらの調査等を行う間は当該ロットのポリオワクチンの接種を見合わせるよう要請した。
その後、同年六月七日の公衆衛生審議会感染症部会及び同月十五日の中央薬事審議会医薬品等安全対策特別部会において、当該ロットのポリオワクチンの品質及び安全性について問題が無いことが確認されたが、ポリオワクチンの接種の再開に向けて国民の理解を得るため、同年秋の予防接種の時期までに、同様の事例が生じた際の対処方法を検討し、ポリオワクチンの接種に関する国民への啓発を行うこと等が必要であるとされた。
これを踏まえて、「ポリオワクチンの予防接種の今後の取扱いについて」(平成十二年六月十五日付け医薬安第八十号厚生省医薬安全局安全対策課長通知・医薬血第三十三号同局血液対策課長通知.健医感発第五十六号同省保健医療局結核感染症課長通知)を発出し、各都道府県にポリオワクチンの接種を再開しても支障が無い旨を通知した。また、同年八月三十一日、公衆衛生審議会感染症部会に設置されたポリオ予防接種検討小委員会において、行政機関向けの「ポリオワクチン接種後の健康障害報告への対応マニュアル」、被接種者の保護者向けの普及啓発資料「「ポリオ」と「ポリオの予防接種」について知っていただくために」等が取りまとめられたことから、「ポリオワクチン接種後の健康障害報告への対応マニュアルについて」(平成十二年九月八日付け健医感発第七十九号厚生省保健医療局結核感染症課長通知・医薬安第百五号同省医薬安全局安全対策課長通知・医薬血第四十九号同局血液対策課長通知)を発出し、ポリオワクチンの接種後の健康障害への対応について周知を図った。
2 DPTワクチンについて
昭和四十九年十二月岐阜県において、また、昭和五十年一月愛知県において、DPTワクチンの接種後の死亡事故が発生したこと、当時百日せきワクチンは副反応が強いワクチンであるとされていたこと等から、「百日せき・ジフテリア・破傷風混合ワクチン等の予防接種について」(昭和五十年二月一日付け衛発第四十九号厚生省公衆衛生局長通知)を発出し、各都道府県にDPTワクチン及び百日せきワクチンの接種を一時見合わせるよう要請した。
その後、伝染病予防調査会予防接種部会において、百日せきの発生状況、百日せきワクチンの効果及び百日せきの治療法等の現状を考慮しつつ、検討が重ねられ、同年三月十九日、DPTワクチン又は百日せきワクチンの接種を直ちに中止することは困難であり、集団接種を行う場合は生後二十四月から四十八月に至る期間に実施し、平常時の接種は個々の小児の健康状態に応じてかかりつけ医が個別接種として行うよう指導すること等が意見として取りまとめられた。
これを踏まえて、「百日せき・ジフテリア・破傷風混合ワクチン等の予防接種について」(昭和五十年四月十四日付け衛発第百九十九号厚生省公衆衛生局長通知)を発出し、DPTワクチン及び百日せきワクチンの接種を再開することとした。